CONSULTAS
Las
consultas y dudas sobre las clases teóricas realizadas
pueden ser dirigidas vía e-mail a:
Profesor
Julio Romero, julio.romero@usach.cl

Preguntas
frecuentes
1. ¿El trabajo efectuado por un sistema se expresa con
signo negativo o positivo?
R:
El signo del trabajo se adopta por convención de
acuerdo a la Primera Ley de la Termodinámica, en
este curso el trabajo efectuado por el sistema sobre los
alrededores se expresará con signo negativo, ya que
se considera como una disminución de energía
interna del sistema. Sin embargo y de acuerdo al tipo de
aplicaciones estudiadas el trabajo efectuado por el sistema
puede expresarse con signo positivo.
2. ¿Qué es una turbina?
R:
Es un dispositivo que se utiliza para la generación
de trabajo a través de la circulación de un
gas. Existen dos tipos de turbinas: a vapor y a gas. Las
primeras funcionan utilizando como fluido de circulación
vapor saturado o sobrecalentado, las segundas funcionan
utilizando el gas que se obtiene de la combustión
de determinados combustibles.
3.¿Cómo
se define el título o la calidad de vapor?
R:
Se define como la razón de masa de vapor sobre la
masa total de una mezcla de líquido + vapor cuando
la mezcla está bajo condiciones de saturación
(es decir Psat o Tsat). Se debe tener ciudado de no confundir
el término calidad con el vocabulario técnico
que se utiliza en la industria donde calidad del vapor puede
implicar la cantidad de impurezas o especies no deseadas
presentes en el agua que ingresa a las calderas.
4. ¿Cuál es la diferencia entre absorción
y adsorción?
R:
La diferencia radica en que mientras la adsorción
es un proceso de superficie en la cual un adsorbato de adhiere
a un adsorbente sólido, la absorción es un
proceso que ocurre en todo el volumen de un cierto sistema
en el cual ocurre una mezcla o disolución.
5. ¿Cómo diferenciar la fisiadsorción
de la quimiadsorción?
R:
Se diferencian por la energía de interacción
entre el adsorbato y el adsorbente, si esta energía
(calor de adsorción) es similar a la energía
necesaria para romper un enlace químico se habla
de quimiadsorción, si por el contrario esta energía
es menor se habla de fisiadsorción. Para poder determinar
que tipo de adsorción se presenta se debe caracterizar
el fenómeno en función de la temperatura.
6. ¿Puede deducirse la ley cinética de una reacción
a partir de la estequiometría de ésta?
R:
No, si bien se puede establecer la constante de equilibrio
de una reacción a partir de la estequiometría,
no se puede establecer la ley cinética (la cual se
obtiene empíricamente y considera la información
sobre el mecanismo de reacción, esta información
no es entragada por al estequiometría).
7. ¿En qué consiste la regla de la palanca?
R:
Es un método para estimar la proporción másica
de cada fase presente en equilibrio y se establece por una
medida de distancias que corresponde a un balance de la
masa total presente en el equilibrio y la composición
de cada fase presente.
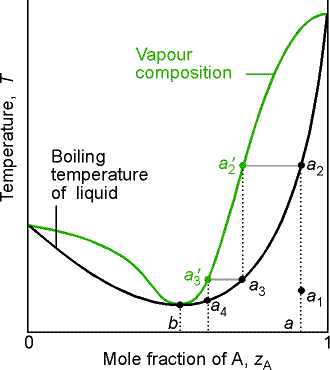
8. ¿Qué es un azeótropo?
R:
Es un punto en el cual el equilibrio de fases está
caracterizado por la composición de un componente
que es igual en todas las fases presentes (xi=yi). Generalmente,
se representa en el gráfico temperatura-composición,
ya que en este punto la separación por destilación
se ve completamente limitada. De esta forma existen azeotropos
de temperatura de ebullición máxima y de temperatura
de ebullición mínima.
9. ¿La constante de equilibrio químico depende
de la presión total del sistema?
R:
No, la constante de equilibrio químico sólo
es una función de la temperatura. Sin embargo, en
sistemas gaseosos, si es posible desplazar el equilibrio
hacia productos o reactantes en función de un cambio
de presión total. De todas formas la constante global
que representa el equilibrio mantiene su valor inalterado
mientras la temperatura no cambie.